Sabine Rosta
Netzhaut aus der Petrischale
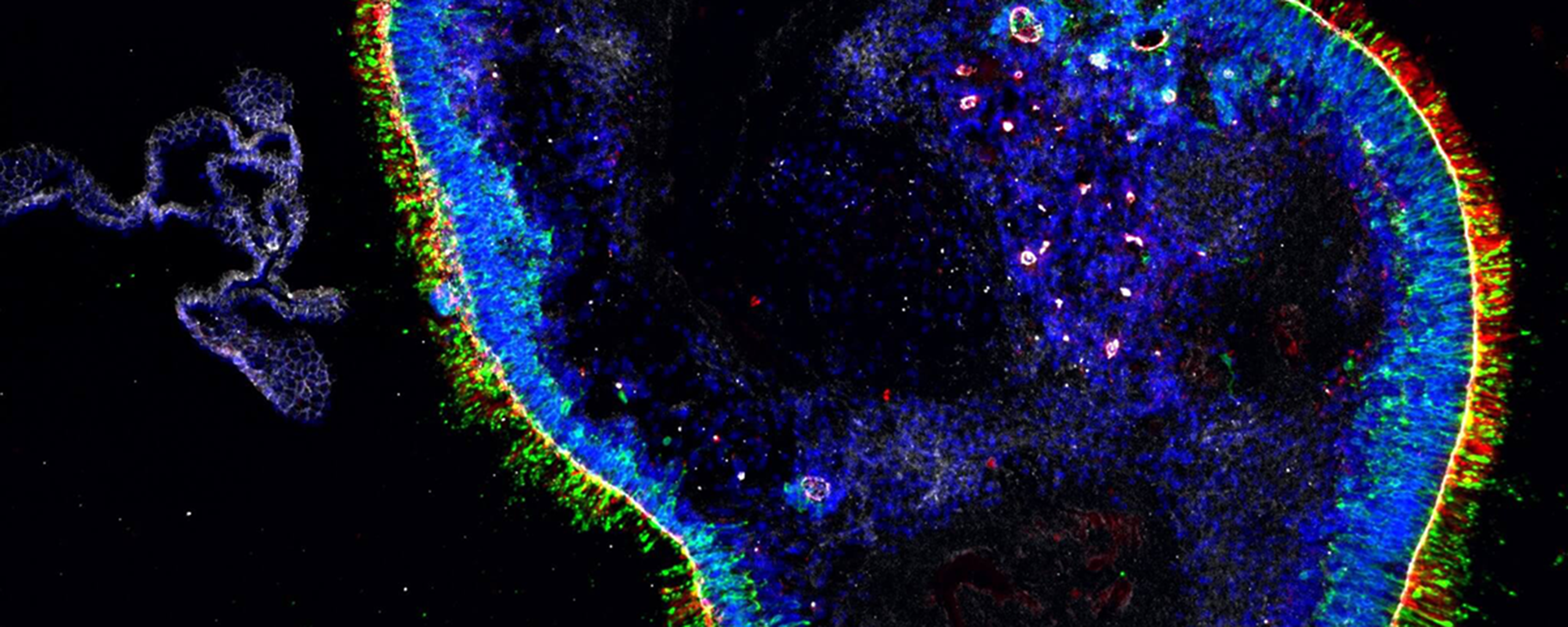
Aus Haut und Blut züchten Magdalena Renner und ihr Team menschliche Netzhaut in Petrischalen. Diese sogenannten Retina-Organoide helfen den derzeit fast 100 Forschenden am Institut für Molekulare und Klinische Ophthalmologie Basel besser zu verstehen, wie das Sehen auf molekularer Ebene funktioniert und wie bestimmte Augenerkrankungen entstehen. Gezüchtete Netzhaut hilft Augenkrankheiten zu erforschen und zu behandeln.
Die Netzhaut unserer Augen ist ein äusserst komplexes Gewebe. «Es gibt fünf Schichten aus verschiedenen Zelltypen. In drei Schichten findet man Zellkörper, zum Beispiel die Lichtsinneszellen namens Zapfen und Stäbchen. Dazwischen gibt es zwei Schichten mit Nervenzellen und deren Verbindungen, den Synapsen», erklärt Magdalena Renner. Ihr ist es gelungen, aus Hautbiopsien oder Blut Stammzellen zu gewinnen und diese so «umzuprogrammieren», dass aus dieser Zellkultur Mini-Retinas heranwachsen. «Theoretisch kann das jede Forschungsgruppe, denn die Methode wurde in Fachzeitschriften beschrieben. Aber meines Wissens sind unsere Retina-Organoide weltweit die einzigen, die wie im menschlichen Auge alle fünf Schichten aufweisen», so Renner.
Aufwändige Züchtung
In der Petrischale bilden sich dreidimensionale Mini-Organe mit einem Durchmesser von etwa zwei Millimetern. Wie echte Netzhaut im Auge verfügen auch sie über Fotorezeptoren, die Lichtsignale aufnehmen sowie Nervenzellen, die diese ans Gehirn weiterleiten würden.
Nicht aus allen Stammzellen entwickeln sich gute Organoide. Die Entwicklung dauert zudem fast genauso lang wie bei der natürlichen Entwicklung einer Netzhaut im menschlichen Embryo: mehr als 30 Wochen. Während dieser Zeit und wenn sie «ausgewachsen» sind, brauchen die Organoide sehr viel Pflege. «Zweimal pro Woche erneuern wir das Nährmedium. Dabei müssen wir sicherstellen, dass keine Infektionskeime oder Viren eindringen können. Solange die Organoide leben – also bis zu zwei Jahre, wenn alles gut geht – arbeiten wir mit ihnen immer unter streng sterilen Bedingungen», erklärt Renner. Der ganze Aufwand macht die Organoide für die Forschung ungemein wertvoll.
Sorgfältigste Pflege
Als die Laborforschung des Instituts für Molekulare und Klinische Ophthalmologie (IOB) im vergangenen Herbst in ein neues Gebäude umzog, wurde darum zuerst getestet, ob die Netzhaut-Organoide darin gedeihen. «Das Gebäude an der Klybeckstrasse wurde sanft renoviert, bevor wir einzogen. Als die Farbe an den Wänden buchstäblich noch feucht und die Einrichtung noch nicht fertig war, stellten wir in unser zukünftiges Labor einen Brutschrank und einen Laminar Flow. Das ist ein Arbeitstisch mit einer grossen Abzugshaube, die sterile Luft herausbläst. So bleibt der Arbeitsplatz steril und man kann dort die Nährlösung der Organoide wechseln. Wir haben dann gewissermassen eine Vorhut an Organoiden dort 14 Tage gepflegt und genau beobachtet, ob sie sich gut weiterentwickeln. Es hätte ja sein können, dass sie im neuen Labor irgend - etwas nicht gut vertragen und schlimmstenfalls absterben. Mein Team und ich waren sehr froh, dass diese Sorge unbegründet war. Wir konnten beruhigt alle Organoide nach und nach in das neue Labor bringen. Sie wachsen und gedeihen dort alle prächtig», erzählt Renner.
Gegen den Sehverlust
Die lebenden Retina-Organoide erlauben die Untersuchung, welche Gene in den rund 100 Zellarten in der Netzhaut zusammenwirken und welche Veränderungen zu bestimmten Netzhauterkrankungen führen. Ein Teil der Netzhauterkrankungen ist vererbbar, zum Beispiel die juvenile Makuladegeneration (Stargardt-Krankheit) oder Retinitis pigmentosa. Betroffene erblinden fast vollständig, ihre Sehfähigkeit geht bis auf wenige Prozent zurück und die Fähigkeit, scharf zu sehen, geht komplett verloren. Etwas lesen, am Computer arbeiten oder Gesichter erkennen, ist nicht mehr möglich, und keine Brille hilft.
Personalisierte Therapie im Test
Das langfristige Ziel der molekularen Grundlagenforschenden, Klinikerinnen und Klinikern am IOB ist es, Behandlungen für bisher unheilbare Augenkrankheiten zu entwickeln, die zu Sehverlust führen. Leider kann man gezüchtete Netzhaut nicht einfach transplantieren. Bei Patientinnen und Patienten mit Fehlfunktion durch eine Gen-Mutation kann man aber versuchen, diese durch eine korrekte Version des Gens zu ersetzen. Funktionierende Netzhaut-Genabschnitte werden dafür in Viren verpackt und in den Augenhintergrund gespritzt. Das IOB entwickelte eine Bibliothek mit mehr als 230 Viren, die sich als «Genfähre» für verschiedene Zelltypen der Netzhaut eignen. Eine Therapie kann im Labor an Retina-Organoiden getestet und verfeinert und vor allem für Patientinnen und Patienten massgeschneidert werden. «Wir können die Netzhaut eines bestimmten Patienten im Labor aus dessen gespendeten Hautzellen oder seinem Blut nachzüchten, mit allen Defekten. Mit diesen Organoiden können wir dann einen personalisierten Therapieansatz prüfen», erklärt Renner.
Schon in wenigen Jahren, so hoffen die Forschenden am IOB, kann eine von ihnen entwickelte Gentherapie gegen die Stargardt- Krankheit an Patienten getestet werden. Das Sehvermögen der Betroffenen soll sich dadurch stabilisieren und der Sehverlust aufgehalten werden. Erkenntnisse aus der Arbeit zur Behandlung der Stargardt-Krankheit sollen zudem zu Fortschritten bei verwandten Erkrankungen führen. Dazu gehört zum Beispiel die altersbedingte Makuladegeneration (AMD), die jeden fünften über 65-Jährigen betrifft und ab dem 75. Lebensjahr bereits jede dritte Person. AMD ist in Industrienationen die häufigste Ursache für Erblindung – und ein Forschungsschwerpunkt am IOB.
Info-Box
Die Netzhaut (Retina) bedeckt das Innere des Auges. Fotorezeptoren in der Netzhaut (Zapfen und Stäbchen) wandeln Lichtimpulse, die auf sie treffen, in elektrische Impulse um. Diese verarbeitet das Sehzentrum auf der Grosshirnrinde zu Bildern. Stäbchen ermöglichen Sehen bei schwachem Licht, farbempfindliche Zapfen ermöglichen uns gestochen scharfes Sehen.
Zapfen und Stäbchen verteilen sich in der Netzhaut nicht gleichmässig. In der Peripherie der Netzhaut befinden sich in erster Linie Stäbchen. Im Zentrum – dem sogenannten gelben Fleck (Makula) – häufen sich die Zapfen.
Die Makula hat einen Durchmesser von etwa sechs Millimetern. Mitten darin liegt das Zentrum für das scharfe Sehen, die Sehgrube namens Fovea. Sie misst nur eineinhalb Millimeter im Durchmesser. Hier drängen sich circa 150‘000 Zapfen. Bei Tageslicht fällt das Licht im Auge direkt auf die Sehgrube. Gegenstände im Zentrum unserer Blickrichtung sind dann für uns am schärfsten sichtbar. Nur manche Vögel sowie unter den Säugetieren nur die Primaten haben eine Fovea. Andere Tiere können ihre Umgebung daher nur schemenhaft wahrnehmen.
Website IOB
Artikel als PDF

Wer ist Magdalena Renner?
Dr. Renner leitet die Organoid Plattform seit 2017, als das Institut für Molekulare und Klinische Ophthalmologie Basel (IOB) von Universitätsspital Basel, Novartis und Universität Basel als Stiftung gegründet worden ist. Sie ist eine von fast 100 Grundlagenforschenden, Klinikerinnen und Klinikern, die am IOB täglich Hand in Hand an einem besseren Verständnis von Augenkrankheiten und an der Entwicklung neuer Therapien arbeiten. Die Forscherin stammt aus Österreich, hat in Wien doktoriert, wo sie einfache Gehirne «nachgebaut» hat. Besonders wichtig ist ihr, dass es «ihren» Organoiden gut geht und dass diese den Forschenden am IOB helfen, rasche Fortschritte zu erzielen auf dem noch langen Weg hin zu Therapien für Netzhauterkrankungen, die bisher grossteils unheilbar sind.